طیفسنجی جذب اتمی (AAS)
در این مقاله به بررسی طیف سنجی به روش جذب اتمی می پردازیم. در این روشِ طیف سنجی، با عبور پرتوی تک رنگ از نمونه مورد بررسی می توان غلظت نمونه را تعیین نمود. اساس این روش بر این اصل استوار است که میزان پرتوی جذب شده هنگام عبور از نمونه، متناسب با غلظت عنصر مورد نظر است. این روش توانایی آنالیز حدود ۷۵ عنصر فلزی و شبه فلزی را دارا است. ولی توانایی آنالیز مواد غیر فلزی را بصورت مناسب ندارد.
آشنایی با طیف سنجی جذب اتمی
طیفسنجی (یا طیفنمایی یا اسپکتروسکوپی) مطالعه ماده و خواص آن، با بررسی نور، صوت و ذرات گسیل شده، جذب شده یا پراکنده شده از ماده مورد نظر است. طیفسنجی به عنوان مطالعه برهمکنش بین نور و ماده نیز تعریف میشود. از لحاظ تاریخی طیفسنجی به شاخهای از علم برمیگردد که برای مطالعات نظری در ساختار ماده و آنالیزهای کیفی و کمی از نور مرئی استفاده میشد. در حال حاضر طیف سنجی به عنوان یک تکنیک جدید نه فقط برای نور مرئی بلکه برای بسیاری از تابشها با طول موجهای متفاوت به کار برده میشود. طیف سنجی جذب اتمی یکی از روشهای طیف سنجی است که به وسیله آن می توان با دقت بالایی غلظت عناصر فلزی موجود در یک نمونه را تعیین نمود.
۱- طیف های جذب اتمی
طیف جذبی یک عنصر در شکل گازی و اتمی آن یک سری خطوط باریک کاملا مشخص است که از جهش های الکترونی بیرونی ترین الکترونها بوجود می آیند. الکترونهای لایه ظرفیت اتم، تابش الکترومغناطیس در گستره فوق بنفش و مرئی را جذب یا نشر می کند. در اتمهای آزاد، بر خلاف مولکولها که دارای ترازهای انرژی ارتعاشی و چرخشی است، فقط جهش های الکترونی صورت می گیرد. به همین دلیل وقتی که انرژی توسط اتمها جذب یا نشر می¬شود، خطوط طیفی مجزا مشاهده می شود، که اساس روشهای طیف بینی اتمی است. مولکولها و یونهای چند اتمی دارای نوارهای جذبی پهن هستند، درحالی که اتمها دارای خطوط جذبی باریک (معمولاً با پهنای ۰٫۰۰۱ الی۰٫۰۱ نانومتر) هستند؛ با این حال دو اثر زیر تمایل دارند که خطوط جذبی اتمها را تا ۰٫۰۲ تا ۰٫۰۵ انگستروم پهن کنند:
-
تعریض داپلر
از حرکت سریع ذرات جذب کننده، نسبت به منبع ناشی می شود. برای اتمهایی که به طرف منبع حرکت می کنند طول موج تابش بطور موثری توسط اثر داپلر کم می شود؛ بنابراین، در واقع طول موج های قدری بلندتر جذب می شوند. عکس این مسئله، درباره اتمهایی که از منبع دور می شوند، نیز صادق است. (اثر داپلر بیان می کند که با توجه به اینکه ناظر به سمت چشمه حرکت می کند یا از آن دور می شود، فرکانسی (یا به عبارتی دیگر طول موجی) که از منبع ساطع می شود را بیشتر یا کمتر دریافت میکند.)
-
تعریض فشاری
برخوردهای بین اتمها سبب تغییرات کوچکی در ترازهای انرژی حالت عادی می شود و در نتیجه پیکها پهن می شوند.
پیکهای جذبی یا نشری باریک که هنگام طیف¬بینی جذب یا نشر اتمی مشاهده می¬شوند، طیف خطی نامیده می شوند.
۲-اصول پایه طیف سنجی جذب اتمی
۱- همه اتم ها می توانند نور جذب کنند.
2- طول موج نوری که جذب می شود برای هر عنصر متفاوت بوده و مختص همان عنصر است.
3- میزان نور جذب شده مستقیما به غلظت اتمهای جذب کننده نور یا به عبارتی به غلظت عنصر مورد نظر در نمونه محلول، بستگی دارد. در تجزیه جذب اتمی، ماده مورد اندازه گیری باید به حالت عنصری کاهش یابد، تبخیر شود و سر راه شعاع تابش منبع، قرارگیرد.
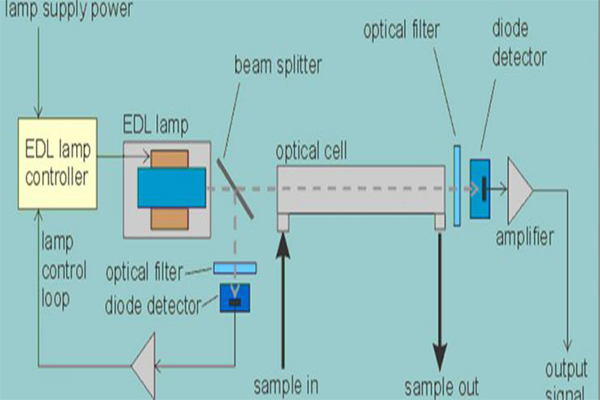
در این فرایند نمونه ها باید بصورت محلول باشند. در اولین قدم آزمایش، محلولِ حاوی عنصر مورد نظر، بوسیله یک شعله که به عنوان مثال با هوا و استلین می سوزد در دمای ۲۰۰۰ درجه سلسیوس (درجه حرارتی پایین تر از طیف تابشی) بخار می¬شود. در اثر بخار شدن، قسمت اعظم عناصر موجود در محلول به حالت خنثی در می آید و پرتوی تابش شده از لامپهای کاتدی (لامپ مخصوص برای هر عنصر) توسط اتم های خنثی شده، جذب می شود. در این حالت شدت اشعه تابش اولیه کمتر می شود. تفاوت شدت دو پرتوی تابشی و خروجی معیار غلظت عناصر موجود در محلول است.
عیب اصلی این تکنیک، وجود نیاز به یک لامپ منبع جداگانه برای هر عنصر مورد تجزیه است. برای رفع این نقیصه کوشش هایی به عمل آمده است تا یک منبع پیوسته به همراه یک تکفام ساز (تکفام ساز، جلوی منبع نور قرار می گیرد و طول موج مورد نظر را عبور می-دهد.) با قدرت جداکنندگی بسیار بالا به کارگرفته شود. اما این تکنیک به اندازه به کارگیری یک لامپ مخصوص برای هر عنصر رضایت بخش نیست.
۳-کاربردهای جذب اتمی
طیفسنجی جذب اتمی یک روش فوقالعاده با کاربرد چندمنظوره در شیمی تجزیه است. غلظت عناصر کمیاب سمی موجود در آب آشامیدنی و چند عنصر معمول دیگر، مانند کلسیم، سدیم و همچنین مقادیر بسیار ناچیز غلظت فلزات دیگر توسط این روش، قابل اندازهگیری است. طیفسنج های جذب اتمی همچنین برای تعیین اینکه آیا سطح درمانی داروهایی نظیر لیتیم در خون، تامین شده است یا خیر و همچنین برای تعیین تراکم آهن در هوای محیط کار، مورد استفاده قرار میگیرد. از جمله کاربردهای دیگر آن عبارتند از: سنجش سرب یا کادمیوم در یک قطره خون ، سنجش نقره در آب باران مصنوعی، جستجوی ناخالصی در آلیاژها و فعال کردن واکنش-گرها، آنالیز آب، آنالیز مستقیم هوا، آنالیز مستقیم سنگ معدن فلزات و فلزهای تصفیه شده، سنجش عناصر آلیاژی در فولاد همانند منگنز، منیزیم، کروم، مس، نیکل، مولیبدن، وانادیم، کبالت، تیتانیوم، قلع، آلومینیوم و سرب.
۴-مزایای دستگاه
دستگاه طیفسنجی جذب اتمی دارای مزایایی است که در زیر آورده شده است:
۱- حساسیت خوب آن برای عناصر مختلف
۲- ساده بودن دستگاه
3- تعیین غلظت عناصر مختلف بوسیله یک محلول
4- دقت، صحت، تکرارپذیری خوب و سرعت بالا
۵-مزاحمتها
مزاحمتهای رایج در طیف نورسنجی چهار نوع هستند که عبارتنداز: شیمیایی، یونش، طیفی و زمینه ای. مزاحمتهای شیمیایی از واکنشهای اتفاق افتاده ناشی می شوند. چون در شعله مقداری از عنصر مورد تجزیه، مصرف می شود، لذا تعداد آنها که باید تابش را جذب کنند کاهش و در نتیجه جذب کاهش می یابد.
از جمله مزاحمتهای شیمیایی، تشکیل اکسیدهای دیرگداز درون شعله با حضور اکسیژن است. مثل تبدیل آلومینیوم و آهن به اکسیدهای دیرگداز Al2O3 و Fe2O3 در حضور اکسیژن. یک راه برای کاهش مزاحمت شیمیایی استفاده از شعله های با دمای زیاد، مانند شعله نیتروز اکسید و استیلن به جای شعله هوا- استیلن است.در این شعله علاوه بر دمای زیاد، با کاهش غلظت اکسیژن در حذف مزاحمت شیمیایی موثراست. راه دیگر برای حذف مزاحمت شیمیایی، افزایش یک ماده رهاساز (بافرطیف بینی) به نمونه مورد تجزیه است. عامل رهاساز ماده ای است که با یک یا چند عوامل مزاحم واکنش می دهد و ترکیبات غیر دیرگداز ایجاد می کند و از تشکیل اکسیدهای دیرگداز جلوگیری می کند. برای مثال، جهت اندازه گیری کلسیم در حضور فسفات، نمک لانتانیم با فسفات ترکیب شده و از تشکیل ترکیب دیرگداز جلوگیری می کند.
مزاحمت یونش زمانی اتفاق می افتد که تعداد زیادی از اتمها درون شعله یونیده شوند و باعث کاهش اتمهای جذب کننده تابش شود. ازآنجا که یونها در طول موج مورد آزمایش برای عنصر مورد تجزیه، جذب ندارند، جذب کم می شود. معمولاً یونش توسط دمای خیلی زیاد شعله اتفاق می افتد و انرژی یونش توسط گرمای شعله تامین شود. مزاحمت طیفی، زمانی اتفاق می افتد که دو عنصر یا یک عنصر و یا یک ترکیب چند اتمی درون سلول، در طول موج مورد نظر، جذب یا نشر داشته باشند. در صورتی که ترکیب مزاحم، تابش را جذب کند منجر به خطای مثبت و اگر تابش را نشرکند، سبب خطای منفی می شود.
مزاحمت زمینه ای، معمولاً توسط جذب گونه های چند اتمی یا پراکندگی تابش درون سلول ایجاد می شود و برای حذف آن از روش افزایش استاندارد نمی توان استفاده کرد. برای حذف مزاحمت زمینه ای، ضروری است که مقدار جذب مربوط به زمینه تعیین و از جذب کل کم شود، تا جذب تصحیح شده مربوط به آنالیز بدست آید.
۶-قانون بیر لامبرت
برای به دست آوردن غلظت نمونه مورد بررسی در طیف سنجی، نیازمند رابطه ای میان میزان نور جذب شده توسط نمونه و غلظت نمونه هستیم که همان قانون بیر لامبرت است. وقتی یک دسته امواج نورانی تکرنگ ازمحیطی وارد محیط یکنواخت دیگر می شود، قسمتی ازآن منعکس و قسمتی جذب محیط دوم و قسمتی هم ازمحیط دوم خارج می شود. رابطه بین شدت نور تابش و خارج شده از محیط، توسط لامبرت (Lambert) در سال ۱۷۶۰ به دست آمد. و بیر (Bear) در سال ۱۷۶۲ درستی آن را درباره محلول ها بررسی نمود و نتیجه گرفت که این قانون درباره محلول ها هم صادق است.
قانون بیر لامبرت یکی از قوانین اصلی در اپتیک است. این قانون تجربی ارتباط شدت نور جذب شده در اثر عبور از ماده همگن بدون پراکندگی را با خصوصیات ماده بیان میکند. این قانون بطورکلی به صورت زیر بیان میشود (رابطه ۱):

که در آن I0شدت نور اولیه، I شدت نور عبوری و A مقدار جذب ماده، α ضریب خاموشی، l ضخامت سلول و c غلظت ماده است (شکل۱).

شکل ۱ – اثر جذب ماده در هنگام برخورد نور به آن. I0 شدت نور اولیه، I شدت نور عبوری و A مقدار جذب ماده، α ضریب جذب ماده، l ضخامت و c غلظت آن است.
چنانچه پرتو جذب شده هنگام عبور از نمونه با dIz و پرتو فرودی با Iz نشان داده شود؛ رابطه زیر بین پرتو جذب شده و فرودی هنگام عبور از قطعه ای از نمونه به طول dz برقرار است (رابطه ۲):

چنانچه از رابطه (۲) در فاصله L=0 و L=L انتگرال بگیریم، خواهیم داشت (رابطه ۳):

که در آن T جزئی از نور تابیده شده است که ازمحیط جاذب خارج شده است، l ضخامت سلول، σ سطح مقطع جذب پرتو (رابطه۴) و N چگالی اتمهای نمونه می باشد. اغلب اوقات میزان عبور را برحسب درصد عبور (T%) معرفی می نمایند.

۶-۱-حدود اعتبار قانون بیر
قانون بیر، منحصراً در شرایط ایده آل زیر اعتبار دارد:
۱- نور عبور کرده ازمحیط جاذب، به مقدار کافی تکرنگ باشد.
۲- C یعنی مولاریته جسم حل شده، نمی تواند به طور دلخواه، هر مقداری درمحلول داشته باشد. قانون بیر-لامبرت غالباً در مورد محلولهای رقیق تر از ۰٫۰۱ مولار، به خوبی صادق است.
۳- نباید تصور شود که انحلال و حضور اجسام بی رنگ در محلول، اگرچه واکنشی شیمیایی هم با جسم جاذب ندهد، برمیزان جذب بی تأثیر است، گاهی اتفاق می افتد که این تأثیر شدید می باشد.
۴- قانون بیر-لامبرت در مورد محلولهای کولوئیدی صادق نمی باشد، چون قسمتی ازامواج نورانی به علت برخورد و پخش، از بین می رود.
۵- قانون جذب، برای امواج IR و UV و همچنین امواج با انرژی خیلی بالا مانند اشعه X و اشعه گاما صادق است.
۶- محیطی که نور را جذب می کند، باید یکنواخت باشد.
۷-طرز تعیین غلظت یک ماده توسط طیف سنجی جذب اتمی
برای اینکه غلظت ماده مورد نظر توسط طیف سنجی جذب اتمی معین شود، باید مراحل زیر را انجام داد:
۱٫ تهیه محلول بلانک (یا محلولی که دارای تمامی گونهها غیر از گونه مورد نظراست.) ۲٫ تهیه نمونههای استاندارد از گونه موردنظر با غلظت های مشخص ۳٫ قرائت جذب محلول های استاندارد ۴٫ رسم جذب برحسب غلظت های استاندارد و بدست آوردن نمودار کالیبراسیون ۵ . اندازهگیری جذب محلول مجهول و بدست آوردن غلظت مجهول از روی نمودار.
ابتدا بایستی محلول بلانک را در سلول قرار داد و شکاف منبع تابش را بست تا ۱۰۰% جذب یا صفر درصد عبور را تنظیم کرد. سپس شکاف منبع تابش، باز شده تا ۱۰۰% عبور یا صفر درصد جذب تنظیم شود. بعد از تنظیم صفر و ۱۰۰، جذب محلولهای استاندارد و همچنین محلول مجهول اندازهگیری میشود.
دو روش در تجزیه کمی رایج است که عبارتند از: روش نمودار کار (یا روش نمودار درجه بندی) و روش افزایش استاندارد. در روش نمودار کار، ابتدا محلولهای استانداردی با غلظت های مناسب و خطی از آنالیت، دقیقاً به همان روش که محلول نمونه تهیه شده است، تهیه می شود. سپس بعد از تنظیم جذب صفر توسط محلول بلانک، جذب محلولهای استاندارد به ترتیب از رقیق به غلیظ توسط دستگاه خوانده وثبت می شود. در پایان، جذب محلول مجهول نیز در همان شرایط ثبت می شود. سپس نمودار جذب برحسب غلظت، برای محلولهای استاندارد رسم می شود و جذب مربوط به محلول مجهول روی آن مشخص کرده و غلظت آن تعیین می شود. دراین حالت دقت نتایج بین دو الی پنج درصد و صحّت آنها در محدوده ۰٫۱ الی۲٫۰ درصد است. روش دیگر که صحّت بیشتری دارد افزایش استاندارد متعدد است. در روش افزایش استاندارد متعدد، به حجم معینی از محلول مجهول (به غلظتx) حجمهای مختلفی از یک محلول استاندارد افزوده، سپس جذب این محلولها بر حسب غلظت رسم می شود و از طریق آن غلظت محلول مجهول بدست می آید. حساسیت در طیف سنجی جذبی عبارت است از مقدار ppm یک عنصر که بتواند مقدار جذبی برابر با ۰٫۰۰۴۴ تولید کند. حد تشخیص یک عنصر برابر مقداری از آن عنصر است، که بتواند پاسخی معادل دو برابر انحراف استاندارد زمینه در آشکار ساز ایجادکند، یا به عبارت دیگر با کمترین مقدار حساسیت برابر است. مقدار حساسیت برای عناصر مختلف در روش جذب اتمی در حدود ۰٫۰۰۰۳ الی ۲۰ppm است.
نتیجه گیری
روش طیف سنجی جذب اتمی یک روش ساده و بادقت بالا برای اندازه گیری غلظت عناصر فلزی بر مبنای میزان جذب طیف عبوری از نمونه در شرایطی که عنصر مورد نظر به صورت اتمی درآمده، می باشد. به دلیل حساسیت بالای این روش می توان از آن برای اندازه گیری عناصر کمیاب سمی موجود در آب آشامیدنی، تعیین اینکه آیا سطح درمانی داروهایی نظیر لیتیم در خون تامین شده است یا خیر و همچنین برای تعیین تراکم آهن در هوای محیط کار، مورد استفاده قرار میگیرد.
منابـــع و مراجــــع
۱- مبانی طیف سنجی مولکولی، سی ان نبول ، ترجمه : دکتر رضا اسلامپور، دکتر مسعود حسن پور.
۲- اصول تجزیه دستگاهی ،جلد اول، اسکوگ ،هالر، نیمس.
۳- L. Ebdon, «An Introduction to Atomic Adsorption Spectroscopy», Heyden, 1982.
۴- Laser Spectroscopy: Basic Concepts and Instrumentation, W. Demtröder, springer, 1996